Das amerikanische Online-CF-Magazin CysticFibrosisNewsToday veröffentlichte innerhalb weniger Tage zur gleichen Substanz gleich zwei Artikel, die wir hier gerne der deutschsprachigen Community zur Verfügung stellen möchten.
Artikel 1 vom 01.06.2020 / Quelle / Übersetzung ohne Gewähr
Pravibismane erhält von der FDA den Orphan-Drug-Status für die Behandlung von CF-Lungeninfektionen
Die Suspensionszubereitung von Pravibismane, eines neuen Typs eines antimikrobiellen Inhalationsmedikaments, das von Microbion entwickelt wurde, hat von der U.S. Food and Drug Administration (FDA) den Orphan-Drug-Status für die Behandlung von Lungeninfektionen bei Patienten mit cystischer Fibrose (CF) erhalten.
Diese Einstufung bietet Anreize für die Entwicklung von Behandlungen seltener Krankheiten – Krankheiten, von denen weniger als 200.000 Menschen in den USA betroffen sind – einschließlich Steuervergünstigungen auf die Kosten klinischer Studien und einer siebenjährigen Marktexklusivität.
„Wir freuen uns, dass wir den Orphan-Drug-Status für unser Inhalationsprogramm mit Pravibismane erhalten haben“, sagte Karim Lalji, Vorsitzender und CEO von Microbion, in einer Pressemitteilung.
Pravibismane (Wismut-Ethanedithiol) gehört zu einer neuen Klasse antimikrobieller Medikamente, die eine andere Struktur haben als die klinisch eingesetzten Antibiotika. Es wirkt auch anders als herkömmliche Antibiotika, die die Bakterien in der Regel abtöten, indem sie deren Vermehrung stoppen oder in die Bildung der bakteriellen Zellwand oder Zellbestandteile eingreifen.
Pravibismane wird als mikrobieller bioenergetischer Inhibitor klassifiziert, was bedeutet, dass es die Fähigkeit der Bakterien stört, die Energie zu produzieren, die für wesentliche Zellprozesse wie DNA-, Protein- und Zellwandproduktion benötigt wird, was zum Absterben der Bakterien führt.
In-vitro-Studien haben gezeigt, dass Pravibismane ein breites antimikrobielles Wirkungsspektrum gegen Bakterien besitzt, die bei Mukoviszidose-Patienten häufig Infektionen verursachen, darunter Carbapenem- und multiresistente Pseudomonas aeruginosa und andere multiresistente Bakterien, die als ernsthafte Bedrohung für Mukoviszidose-Patienten gelten.
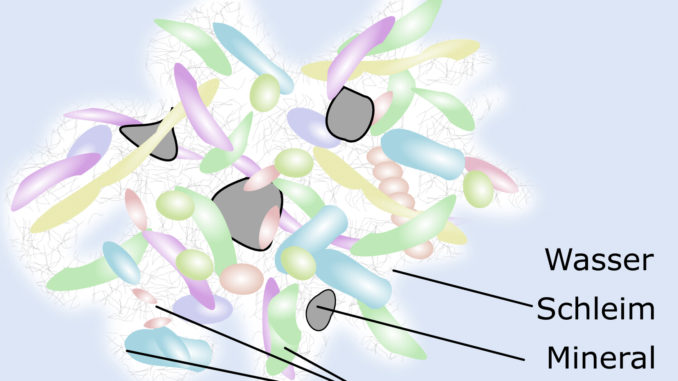
Eine weitere Art und Weise, wie Pravibismane Bakterien bekämpft, ist die Beeinträchtigung der Bildung von Biofilmen – einer Art Schild, der von Bakteriengemeinschaften gebildet wird und sie vor Antibiotika und dem Immunsystem des Patienten schützt. Das Vorhandensein von Biofilmen in den Lungen von Mukoviszidose-Patienten trägt zu chronischen und anhaltenden Lungeninfektionen bei.
„Diese Einstufung steht im Einklang mit unserem beharrlichen Engagement für die Entwicklung innovativer Lösungen zur Behandlung chronischer Lungeninfektionen bei Mukoviszidose-Patienten. Wir werden eng mit der FDA und wichtigen Interessenvertretern zusammenarbeiten, um inhalatives Pravibismane zum Wohle der Mukoviszidose-Patienten zur Zulassung zu bringen“, sagte Lalji.
Abgesehen von der Einstufung als Orphan-Medikament hat die FDA Pravibismane auch eine qualifizierte Produktkennzeichnung für Infektionskrankheiten erteilt – für antibakterielle oder antimykotische Medikamente zur Behandlung schwerer oder lebensbedrohlicher Infektionen sowie eine Schnellzulassung – um die Entwicklung von Medikamenten zur Behandlung schwerer Erkrankungen, die einen bislang ungedeckten medizinischen Bedarf decken, zu erleichtern und die Prüfung dieser Medikamente zu beschleunigen.
Artikel 2 vom 04.06.2020 / Quelle / Übersetzung ohne Gewähr
Mikrobion erhält 17 Mio. $ für inhalatives antimikrobielles Pravibismane zur Vorbeugung von Lungeninfektionen
Microbion hat von der gemeinnützigen CARB-X und der Cystic Fibrosis Foundation bis zu 17,1 Millionen US-Dollar zugesagt bekommen, um präklinische sowie klinische Studien der Phase 1 für sein inhalatives antimikrobielles Medikament Pravibismane zur Behandlung von Mukoviszidose-Patienten (CF) mit Lungeninfektionen durchzuführen.
CARB-X – Combating Antibiotic-Resistant Bacteria Biopharmaceutical Accelerator – ist eine globale Partnerschaft, die 2016 ins Leben gerufen wurde und die sich der Beschleunigung der Entwicklung neuer Antibiotika widmet, mit denen der wachsenden Herausforderung durch arzneimittelresistente Bakterien begegnet werden soll.
Pravibismane ist das erste inhalative Antibiotikum zur Behandlung von Lungeninfektionen bei Mukoviszidose-Patienten und das erste, das von CARB-X den Förderungszuschlag erhalten hat. Die Investition der Non-Profit-Organisation wird auch die Bemühungen der Hersteller unterstützen, Pravibismane für klinische Studien bereitzustellen.
Die Finanzierung beläuft sich auf 11,5 Millionen Dollar – bis zu 6,1 Millionen Dollar als anfängliche Mittelzusage plus bis zu 5,4 Millionen Dollar in Erwartung des Erreichens von Meilensteinen – von CARB-X und bis zu 5,6 Millionen Dollar von der CF Foundation. Dies folgt auf die kürzlich erfolgte Einstufung von Pravibismane als Orphan-Medikament durch die U.S. Food and Drug Administration (FDA) zur Behandlung von Lungeninfektionen bei CF-Patienten.
„Wir sind dankbar für diese bedeutende Unterstützung durch CARB-X und die Cystic Fibrosis Foundation, um inhalatives Pravibismane als einen neuartigen Ansatz für die Behandlung chronischer respiratorischer und antibiotikaresistenter Infektionen zu untersuchen“, sagte Karim Lalji, Vorsitzender von Microbion, in einer Pressemitteilung.
„Über ihre Investitionen hinaus wird sich das Fachwissen dieser Organisationen in Bezug auf antibiotikaresistente Infektionen, insbesondere solche, die mit Mukoviszidose in Verbindung gebracht werden, als wertvoll erweisen, um unsere Technologie als Teil einer dringend benötigten Lösung zur Bekämpfung der chronischen und hartnäckigen Infektionen, die ein Charakteristikum der Mukoviszidose sind, voranzubringen“, fügte Lalji hinzu.
Pravibismane gehört zu einer neuen Klasse antimikrobieller Medikamente, die als mikrobielle bioenergetische Hemmstoffe bezeichnet werden. Sie haben eine andere Struktur als andere Antibiotika und wirken darauf hin, die Energieproduktion in Bakterien zu stören, indem sie sie daran hindern, neue DNA-Moleküle, Proteine und Zellwände zu bilden, was letztlich zum Absterben der Bakterien führt.
In präklinischen Studien hat die Therapie ein breites Spektrum, eine starke und anhaltende Wirkung gegen mehrere Bakterien gezeigt, die Infektionen bei Mukoviszidose-Patienten verursachen, einschließlich des multiresistenten Pseudomonas aeruginosa und der dicken Biofilmschicht, die die Bakterien erzeugen.
„Die Infektion ist eine Hauptsorge sowohl der Patienten als auch der CF-Kliniker und bleibt eine der Hauptursachen für den Verlust der Lungenfunktion bei Menschen, die mit Mukoviszidose leben“, sagte William Skach, MD, Chief Scientific Officer der CF-Stiftung. „Da Menschen mit Mukoviszidose vermehrt gegen chronische Infektionen und Antibiotikaresistenzen ankämpfen, brauchen wir heute mehr denn je neuartige, sichere und wirksame Antiinfektiva“, so Skach.
Der Biofilm bildet eine Schutzschicht, die verhindert, dass Antibiotika und Immunkomponenten die Bakterien erreichen. Die Bekämpfung dieser komplexen Biofilme, die weitgehend für die chronischen und anhaltenden Lungeninfektionen bei Mukoviszidose-Patienten verantwortlich sind, stellt eine einzigartige Strategie dar, um den Patienten zu helfen, ihre Lungenfunktion zu erhalten und ihre Lebensqualität zu verbessern.
Insbesondere ist Pravibisman in der Lage, Bakterien und Biofilme in Gegenwart von CF-Sputum, einer dicken Schleimschicht, die das Innere der Lunge bedeckt, zu eliminieren.
„Die neue Klasse der Antiinfektiva von Microbion stellt ein neuartiges Medikament dar, das eine starke Aktivität gegen antibiotikaresistente bakterielle Krankheitserreger und die Biofilme, die diese Erreger erzeugen, gezeigt hat“, sagte Erin Duffy, Leiterin der Forschung und Entwicklung bei CARB-X.
„Pravibismane von Microbion hat das Potenzial, eine entscheidende neue Waffe im Kampf gegen chronische und resistente Infektionen zu werden, wenn es erfolgreich ist und schließlich für den Einsatz bei Patienten zugelassen wird“, sagte Duffy.


Hinterlasse jetzt einen Kommentar